Человек, как и другие многоклеточные подвержен микробным инфекциям. Так что можно сказать, что с начала его существования он стоял перед задачей выздоровления от них, как и микроорганизмы стояли перед задачей поиска экологических ниш и размножения.
Одним из способов обеспечения выздоровления от инфекции является антимикробная терапия.
Принципиальная уникальность препаратов для этого типа терапии и вообще подхода к лечению состоит в том, что для лечения болезней организма хозяина (например, человека) мишень не является частью человека, это иной организм, чаще микроорганизм.
Предыстория
Обычно большинство работ на эту тему начинаются с истории открытия пенициллина, некоторые — с поиска Эрлихом «волшебной пули» и начала применения сальварсана. Хотя можно было бы начать и с лечения сифилиса препаратами ртути или применения с той же целью гваякума, или с работ честного и смелого Земмельвейса, или с применения фитопрепаратов, например, для лечения инфекций мочевых путей.
На мой взгляд, логично все-таки начать точку отсчёта с сальварсана. Итак, 111 лет назад был синтезирован первый целенаправленно созданный антимикробный препарат на основе мышьяка, а 108 лет назад он был внедрен в практику. Предназначен он был для лечения сифилиса. Это положило начало и привело к поиску других, менее токсичных препаратов для иных инфекций, что и закончилось открытием антибактериальных свойств пронтозила (стрептоцида) и других антибактериальных сульфаниламидов и внедрением их в клиническую практику в тридцатых годах прошлого века. Чуть ранее в 1928 году, благодаря наблюдательности Флеминга, начался поиск пенициллина. И наконец в 1940 году Чейном и Флори, всего 78 лет назад, был выделен пенициллин. Немного позже он был внедрен в практику. Таким образом, с момента широкого внедрения с клиническую практику сульфаниламидов и, особенно, после внедрения антибиотиков, в медицине началась совсем другая эпоха – эпоха применения антимикробных препаратов высокой активности и низкой или относительно низкой токсичности.
А что же другая заинтересованная сторона — микроорганизмы? Их история несколько более древняя. Прокариоты возникли гораздо раньше эукариот, еще в период архея и практически бескислородной атмосферы. Около 2,5—3,5 млрд лет назад появились бактерии. Сроки являются не очень точными. Но это произошло настолько давно, что ученые с легкостью бросаются десятками и даже сотнями миллионов лет в датировании их возникновения. Все равно очень давно. За этот период микроорганизмы, в частности бактерии, стали доминирующими живыми существами на планете. Часть видов нашли свою экологическую нишу и стали патогенами или комменсалами макроорганизмов. Часть видов просто существует во внешней среде.
Возникновение и механизмы резистентности, антибактериальные препараты
Однако все виды длительный период времени, исчисляемый миллиардами лет, приспосабливались как к ошеломляющим изменениям климата и состава атмосферы, освещенности, так и боролись за источники пищи и территорию друг с другом. В том числе выработкой определенных веществ, направленных против других микроорганизмов. Логично предположить, что тогда же возникли и механизмы резистентности к этим веществам. Самый простой путь — у микроорганизма, продуцирующего вещество, токсичное для других микроорганизмов, не должно быть к нему мишени. Не случайно природные антибактериальные антибиотики в большом количестве обнаружены именно у грибов. Более сложный путь — есть мишень, сходная как у продуцента токсического вещества, так и у тех микроорганизмов, против которых направлено вещество. Значит должны быть какие-то механизмы обезвреживания этого вещества, поскольку защищаться от них должна и сама бактерия, продуцирующая вещества, токсичные для других. Иначе такой способ борьбы с конкурентами был бы недолгим.
Да и атакуемые микробы тоже защищались от антибиотиков и бактериоцинов, продуцируемых как грибами, так и бактериями. Соответственно, у многих микроорганизмов гены резистентности к антибиотикам и механизмы их распространения прошли сито эволюции за сотни миллионов лет и дошли до наших дней.
Что в общем то и подтверждается, например, находкой генов, кодирующих механизмы резистентности к бета-лактамам, тетрациклинам и гликопептидам у микроорганизмов в вечной мерзлоте Канады давностью 30000 лет [1].
И вот в этот мир микроорганизмов около 170 лет назад вмешался человек со своими антисептиками и в последующем с антимикробными препаратами.
Начав достаточно широко применять антисептики около 150 лет назад и системные антимикробные препараты (сульфаниламиды) чуть более 80-ти лет назад, он, естественно, раскрутил маховик селекции, который совершенствовался миллиарды лет и придал определенные направления механизмам резистентности. Это прекрасно иллюстрируется тем, сколь быстро появляются устойчивые штаммы к новым антибиотикам.

Как видно из этих двух шкал резистентность развивается быстро, а новые классы антибиотиков давно не вводились в практику.

Более того, обратите внимание на вторую диаграмму. Это годы открытия классов антибиотиков и годы их внедрения. Иногда разрыв очень долгий. Особенно показательны последние введенные в практику новые классы — стрептограмины, оксазолидиноны и липопептиды, которые были открыты задолго до начала их практического применения. А оксазолидиноны открыты вообще за полсотни лет до внедрения! Из этих двух диаграмм напрашивается вывод, что, хотя сегодня мы имеем больше проблем с Гр- инфекциями, маятник через некоторое время качнется в другую сторону, как уже было, и проблемы с резистентными Гр+ инфекциями возрастут, в том числе и потому, что мы до сих пор «проедали» старые разработки, и принципиально новых классов для борьбы с Гр+ не открыто. То, что внедрено в практику — это цефалоспорины с активностью против MRSA (метициллин-резистентный Staphylococcus aureus), пептидные антибиотики, новые производные тетрациклинового ряда, оксазолидинонов и некоторые фторхинолоны.
В разработке находятся пенемы, гликопептиды, оксазолидиноны, цефалоспорины, комбинации старых карбапенемов и цефалоспоринов с новыми ингибиторами бета-лактамаз, плевромутилины. Из инновационных препаратов на фазе 1-2-й ингибиторы FabI, дефенсин миметики, ингибиторы бактериальной гиразы В (ДНК-гираза типа II) и гибриды цефалоспоринов и гликопептидов с хинолонами [2] . Из них только ингибиторы FabI и дефенсин миметики можно отнести к новым классам, да и с некоторой натяжкой ингибиторы гиразы В. Гибридные молекулы все-таки это не принципиально новые классы. Но, имеющиеся на данный момент препараты лишь с трудом позволяют отвечать на все нарастающую резистентность с Гр+ инфекциями. А задел на будущее очень слабый.
Да и вытаскивали из закромов эти старые классы препаратов только потому, что других не было. А ведь в свое время на пыльную полку они попали не просто так. У них были недостатки — по спектру, по ФК-ФД, побочным эффектам, стоимости. Просто сейчас настолько выросла резистентность, настолько стало нечем лечить резистентные инфекции, что и они пригодились.
Все это в настоящее время и привело к кризису антибактериальной терапии и минимум 700000 ежегодных смертей в мире от резистентных микроорганизмов.
Причины сложности разработки новых антибиотиков не случайны
Их можно разделить на несколько групп:
- Биологические причины сложности открытия новых классов антибиотиков
- Молекулы-родоначальники почти всех классов антимикробных препаратов, которые уже открыты, взяты в природной среде. Нередко это относится и к группам внутри классов.
- Следовательно, эти антимикробные молекулы были направлены на такие мишени, что прошли сито естественного отбора. Надо найти новые мишени, на которые будут действовать антибиотики, но самые оптимальные уже были «найдены» микроорганизмами и закреплены естественным отбором. Они были достаточно эффективны для своих носителей и к ним относительно медленно развивалась резистентность у тех микробов, против которых они направлены. Вероятно, они существуют уже как минимум десятки тысяч лет. Поэтому, новые эффективные классы антимикробных препаратов открывать сложнее.
- Механизмы резистентности у микроорганизмов нередко достаточно универсальны. Например, эффлюкс ксенобиотиков из клетки, утрата/модификация поринов. Следовательно, даже если найти новый класс антимикробных препаратов (АМП), действующих на новую мишень, это еще не гарантирует, что он не будет подвергаться действию старых механизмов резистентности. Следовательно, новый антибиотик должен разрабатываться еще и с учетом этих требований.
- Микроорганизмы имеют также механизмы резистентности, свойственные не каждой отдельно взятой бактерии, а колониям. Например, образование биопленок. Проверка активности препарата в этих условиях сложна дорога и менее точна.
- Зависимость активности антимикробного препарата от рН среды и её минерального состава.
- Сложности со стороны хозяина
- АМП должен иметь приемлемый профиль токсичности (особенно сложно отследить редкие, но тяжелые побочные реакции, как было, например, с гепатотоксичностью тровафлоксацина).
- Приемлемую фармакокинетику.
- Проходить гистогематические барьеры.
- Низкое влияние на собственную флору.
- Приемлемый спектр и уровень лекарственных взаимодействий.
- Не разрушаться ферментными системами хозяина.
- Регуляторно-научные сложности
- Поиск новых классов антибиотиков зависит во многом от новых знаний о микроорганизмах, от поиска потенциальных мишеней в микробах, то есть от общебиологических знаний.
- Доказательство эффективности и безопасности надо проводить для каждой нозологии или группы нозологий отдельно, а иногда и с учетом микроорганизма при каждой нозологии.
- Необходимо не только подтвердить клиническую эффективность, но и продемонстрировать бактериологическую и доказать это, исходя из параметров ФК-ФД.
- При многих инфекциях невозможен плацебо контроль.
- В силу неизбежного появления и нарастания резистентности обязательно требуется постоянный мониторинг за эффективностью и коррекция режимов дозирования.
- Экономические сложности
- Стоимость разработки и, особенно, клинических исследований высока и продолжает возрастать.
- Жизненный цикл антимикробных препаратов короткий.
- Следовательно, надо делать их дорогими, чтобы компании-разработчики получили желаемую норму прибыли.
- Высокая цена — препятствие к продвижению, а низкая не дает ожидаемой нормы прибыли для инвесторов.
- Обязательно требуется постоянный мониторинг за эффективностью и коррекция режимов дозирования, что влечет за собой новые исследования и расходы.
- Классическая для «большой фармы» модель извлечения прибыли непривлекательна для инвесторов по сравнению другими группами препаратов.
- Ментальные и маркетинговые сложности
- Врачи ждут новых антимикробных препаратов широкого спектра действия для эмпирической терапии, которые просто заменят старые препараты широкого спектра и все будет как раньше. Но нужно понимать, что этого уже не будет, что новые препараты – это не замена препаратам широкого спектра действия. Большинство новых препаратов или комбинаций решают проблему с какими-то определенными механизмами резистентности у конкретных видов микроорганизмов.
Например меропенем/ваборбактам активен в отношении энтеробактерий, продуцирующих сериновые карбапенемазы, менее активен в отношении металло-β-лактамаз, и не повышает эффективность меропенема против резистентных A. baumannii, P. aeruginosa, S. maltophilia. - Низкая социальная ответственность бизнеса поддерживает старую модель маркетинга. Старые подходы к позиционированию антибактериальных препаратов себя изжили, нужны новые модели маркетинга препаратов.
Однако мышление маркетологов также не меняется. Например, один из последних антибиотиков, утвержденных FDA – эравациклин. Посмотрите ниже на сайт XERAVA (https://www.xerava.com/). Очевидно, что компоновка текста на странице, слоган, размер и тип шрифтов выбраны таким образом, чтобы фиксировать внимание на возможности эмпирического назначения без раздумий. А то, что эта «эмпиричность» касается ограниченных категорий пациентов и даже для них весьма условна — это пишется максимально маленьким текстом. Еще бы вообще 5-м размером шрифта написали вертикально на последней странице. И эти маркетологи явно гордятся собой.
- Врачи ждут новых антимикробных препаратов широкого спектра действия для эмпирической терапии, которые просто заменят старые препараты широкого спектра и все будет как раньше. Но нужно понимать, что этого уже не будет, что новые препараты – это не замена препаратам широкого спектра действия. Большинство новых препаратов или комбинаций решают проблему с какими-то определенными механизмами резистентности у конкретных видов микроорганизмов.
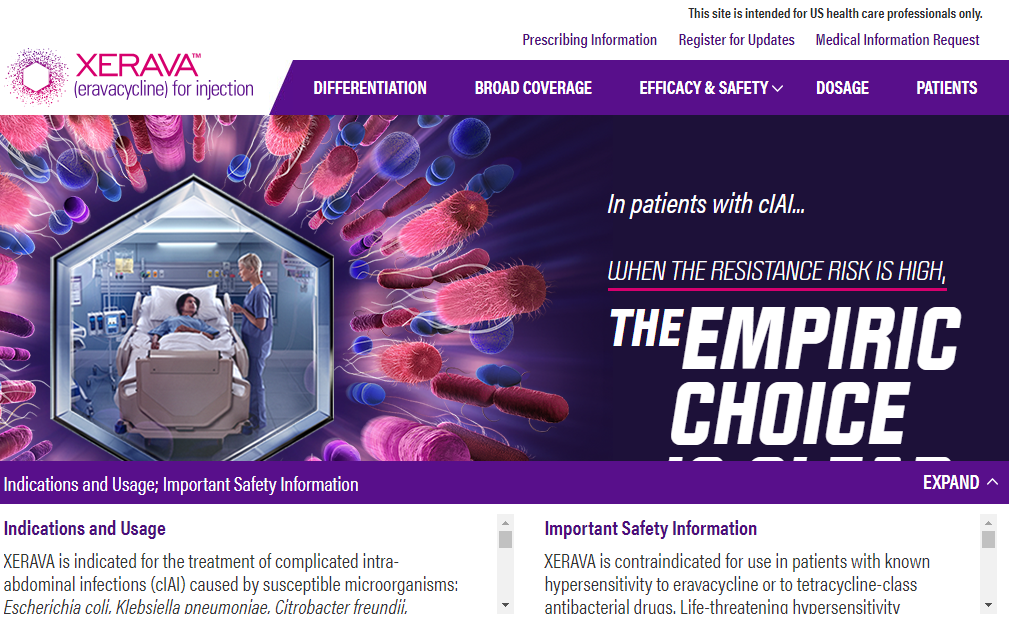
Однако, зачем далеко ходить — лет 14 назад с легкой руки одной европейской компании ципрофлоксацин продвигался для лечения негоспитальных пневмоний, как стартовый препарат для лечения пациентов старше 35 лет. Якобы из-за гемофильной палочки. Мало того, что это не имело бактериологического и клинического смысла, так еще и было вредным, поскольку подкладывало мину замедленного действия под все «респираторные» хинолоны.
Стали ли более осмысленными маркетинговые стратегии сейчас? Отнюдь. Пример тому реклама флуконазола в Украине, нацеленная на пациента. Вот, например, скрины за 2011 и 2015 года. Реклама идет годами.
| 2011 год | 2015 год |
 |  |
Это однозначно увеличивает риски формирования резистентной к флуконазолу C. albicans и, возможно, увеличивает распространение исходно нечувствительных к флуконазолу не-C. albicans штаммов. И конечно же, нет никакого контроля влияния этой рекламы на данные вопросы. Ладно, оставим в стороне социальную ответственность бизнеса и каждого отдельного человека. Ладно, те кто давал разрешение на рекламу антимикробного препарата для пациента чаще всего лечатся за счет бюджета. Однако все остальные, принимавшие в этом участие: маркетологи, рекламисты — задумывались ли они о том, хватил ли им их бонусов или даже «личных комиссионных» на то, чтоб вылечить себе или своему ребенку эхинокандинами, например, кандидозный эзофагит устойчивый к флуконазолу. Причем его возникновение вполне реально после любого курса антибактериальной терапии.
Примеров нерационального использования антибиотиков много. Обойтись без них нельзя. Но и выиграть у микробов в этой гонке нельзя. Резистентность эволюционно неизбежна. Мы живем в мире микроорганизмов, а не наоборот. Но можно было бы свести к минимуму потери в этой эволюционной войне и разумно распределить возможности. Причем сделать это надо было c самого начала. Но, имеем то, что имеем.
Последствия бесконтрольного применения АМП и возможные пути коррекции
Итак, какие же ожидаемые последствия этой ситуации и возможные меры по ее коррекции? Рассмотрим детально анализ ситуации и рекомендации рабочей группы из Великобритании.
2014 год — О нехватке антибиотиков, способных преодолеть нынешнюю проблему резистентности, заявили Всемирная организация здравоохранения, президент США Барак Обама, а также премьер-министр Великобритании Дэвид Кэмерон. Ими было озвучено, что резистентность микроорганизмов является угрозой национальной безопасности. Ни более, ни менее. В июле 2014 года премьер-министр создал рабочую группу, которая занимается проблемой резистентности к антимикробным препаратам, возглавляемую Лордом Джимом О’Нилом
2014 год [3] — В своем первом отчете рабочая группа Джима О’Нила провела оценку возможного влияния проблемы резистентности к антимикробным препаратами и определила нынешние, а также вероятные потери — сейчас смертность 700 тыс. человек в мире каждый год, если не бороться с резистентностью, то, согласно этого отчета, к 2050 году более 10 млн человек по всему миру будет погибать от инфекций, вызванных устойчивыми к антимикробным препаратам микроорганизмами. Экономический ущерб от данной проблемы оценивается более чем в 100 трлн долларов. Это фантастическая сумма!
Во втором своем отчете в 2015 [4] году данной рабочей группой были определены основные пути коррекции ситуации и способы борьбы с последствиями антимикробной резистентности:
- Решение вопроса финансирования. Создание инновационного фонда для обеспечения финансирования новых идей на более ранних этапах.
- Сохранение имеющихся препаратов. Критически важно сохранение тех медицинских препаратов, которые у нас уже имеются.
- Важность новых технологий диагностики:
- Необходимо обеспечить назначение антибиотиков лишь в случаях заражения бактериальными инфекциями.
- Гораздо более взвешенными должны быть решения о том, какие препараты и против каких инфекций следует применять.
- Быстро определять степень чувствительности и ограничить применение антибиотиков широкого спектра действия.
- Квалифицированный персонал. Для мониторинга АМП и реализации программ контроля за применением антибиотиков и назначения антибактериальных препаратов. Во многом это вопрос оплаты. Да и в развитых странах зарплаты специалистов по антибактериальной терапии существенно уступают многим врачебным специальностям. Проблема признается и решается. А у нас? Вопрос похоже риторический.
- Доступность информации. На глобальном уровне упростить доступ к информации здесь и сейчас для тех, кому она нужна.
В третьем отчете за 2016 год [5] рассмотрена проблема поиска новых антимикробных препаратов.
Вывод третьего отчета — чтобы сделать процесс исследований и разработки коммерчески выгодным нужен более предсказуемый рынок. Также необходимо отделить прибыль от объемов продаж. Это и будет решением экономического тормоза разработки новых противоинфекционных препаратов и тех отклонений в продвижении антимикробных препаратов, которые наблюдаются сейчас. В качестве иной модели предлагаются фиксированные платежи представителям фармбизнеса за разработку, лицензирование и продвижение препаратов при условии их доказанной эффективности.
Источники информации
- D’Costa VM at al. Nature 2011; 477:457-461
- Antibiotics Currently in Global Clinical Development Sept 2018
- Antimicrobial Resistance: Tackling a crisis for the health and wealth of nations. The Review on Antimicrobial Resistance Chaired by Jim O’Neill December 2014
- Tackling a global health crisis:initial steps. The Review on Antimicrobial Resistance Chaired by Jim O’Neill February 2015
- TACKLING DRUG-RESISTANT INFECTIONS GLOBALLY: FINAL REPORT AND RECOMMENDATIONS THE REVIEW ON ANTIMICROBIAL RESISTANCE CHAIRED BY JIM O’NEILL MAY 2016








Спасибо за статью! Очень интересно.
Добавлю свои пять копеек. Недавно просматривал статьи о новых (и не очень) радиофармпрепаратах и натолкнулся на статьи о меченных антибиотиках. Пока предлагают их использовать для целей диагностики бактериальных поражений, но, возможно, в будущем с ростом резистивности бактерий их будут использовать для госпитальных инфекций. Главное, изотоп внутрь клетки протащить.
Спасибо за отзыв и информацию. Это уже есть такие идеи, наработки? Потому что с практической точки зрения применение и разработка таких препаратов проблемно и очень дорого ввиду сложностей со стабильностью изотопа, собственно создания препарата, мутагенной активностью, клинических испытаний, защиты персонала, деактивации стоков больницы и много еще чего.
Для диагностики уже есть наработки, только толком еще не копал в том направлении и не понял есть ли уже в обращении эти лекарства. Пара статей за 2015 год (вторая статья – обзор) – “99mTc-amoxicillin. A novel radiopharmaceutical for infection imaging” и “Currently Available Radiopharmaceuticals for Imaging Infection and the Holy Grail”
Про проблемность и дороговизну знаю, плюс тут еще и возможность их использования строго ограничена клиниками с соответствующим оборудованием и условиями.
Большое спасибо, скачал. Изучаю)))
Пожалуйста 🙂
Дмитрий, спасибо за статью – готовая лекция. Очень хорошая структура и постепенно затягивает 🙂 Мне очень интересен момент “вытаскивали из закромов”. Это Вы имеете в виду зарегистрированные препараты? Встречались ли случаи, когда несколько лет назад, например, соединение не прошло регистрацию из-за токсичности (а это одна из первых причин неуспеха кандидатов), но с развитием резистентности оказалось, что оно “не такое уж и токсичное”? В целом, я хочу спросить, есть ли вторая жизнь у провалившихся соединений-кандидатов в связи с развитием резистентности?
Ольга, спасибо за интерес к этой теме, и конечно радует, что статья нравится. В хорошей структуре, как и писал, не обошлось без участия Антона. Тут у нас синергизм 🙂
Вытаскивали из закромов – я имел ввиду больше молекулы или классы, которые были открыты давно, но по каким то соображениям были признаны на тот момент как неперспективные для дальнейшего вложения средств и не подавались в регистрацию. Вопрос не столько в абсолютной токсичности, сколько в том, что данные молекулы (классы) проигрывали по сумме показателей другим молекулам, на тот момент более перспективным коммерчески. Соотношение риск/польза, эффективность/стоимость, затраты на разработку/шансы регистрацию было таково, что принято было решение, что слишком малый рынок получат эти препараты, а значит надо вложить средства туда, где выше прибыльность.
Если уж препарат попал на клинические фазы, шансы что он не пойдет в рынок небольшие. Затраты на вывод исчисляются миллиардами, около 2-2,6 млрд долларов, поэтому нередко даже сомнительный препарат выводят, пусть и по ограниченным показаниям, надо же как то вернуть инвестиции. Тем более, что при каждом решении еще и оценивается, как это повлияет на стоимость акций компании в конкретный временной период.
Вторая жизнь у провалившихся кандидатов возможна, иногда после незначительной модификации. Возможно ее получат кетолиды. Телитромицин и солитромицин давно в разработке, но не вышли в клинику, в частности телитромицин по гепатотоксичности. Но, их не списывают со счетов. Они исследуются. И когда резистентность пневмококка и микоплазм к ныне применяемым препаратам при респираторных инфекциях вырастет до еще больших величин, их шансы выйти на рынок увеличатся, так как соотношение риск/польза/стоимость изменится. Хотя, конечно, будет давление со стороны некоторых молекул других классов – например делафлоксацина, забофлоксацина, омадациклина, возможно новых пероральных карбапенемов.
Также ко второй жизни реально можно отнести выраженное расширение использования препаратов, которые хотя и были зарегистрированы, но очень незначительно использовались системно ввиду токсичности. Классическим таким примером является широкое применение парентеральных полимиксинов в последнее десятилетие. Они начали применяться так широко парентерально ввиду быстрого роста частоты инфекций вызванных карбапенемрезистентными Гр отр. неферментирующими возбудителями (синегнойная палочка, ацинетобактер) и клебсиеллой. Раньше, при высокой активности карбапенемов, даже в случаях недостаточной эффективности их комбинировали с аминогликозидами, и, в подавляющем большинстве случаев, проблему решали, так что применение полимиксинов системно воспринималось как из ряда вон выходящая ситуация, ну например очень редкий пациент у которого не только флора со сниженной чувствительностью к карбапенемам, но и еще допустим аллергия на карбапенемы или аминогликозиды. Сейчас уже для ухода от терапии полимиксинами этих проблемых инфекций выведены на рынок цефтазидим/авибактам, цефтолозан/тазобактам и меропенем/ваборбактам. Однако они полностью проблему не решают, так что парентеральное применение полимиксинов хоть и сократится немного, но не избежать его.
Вот и получилась еще одна мини-статья 🙂 Дмитрий, большое спасибо за подробный ответ, это очередное небольшое открытие для меня. Жалко только, что большая часть информации по провалам остается закрытой. Это уже не по антибиотикам вопрос, но вот интересно, существуют ли организации, систематизирующие опубликованные данные по неудачным кандидатам?
Добрый день Ольга.
Насчет организаций систематизирующих опубликованные данные по неудачным кандидатам ЛС (не только антибиотиков) – никогда не интересовался эти вопросом специально, но и никогда не находил таковых. База данных такого типа безусловно была бы в какой то степени полезна. Но очень ли она нужна?
Ведь исследователи, работающие над какой то практической задачей, обычно неплохо знают о всех публикациях по этой теме , тем более, базы типа драгбанка содержат массу структурированной информации.
Интересно узнать мнение других читателей, может подтянутся научные работники, если таковые тут есть.
Хотелось бы высказать большую благодарность Антону. Именно он является автором идеи этой статьи. Мы не раз обсуждали вопросы, связанные с антиинфекционной терапией. Меня больше всего интересовали вопросы практического применения, использования в практике параметров ФК-ДФ, прогнозирования резистентности, вопросы взаимодействий антимикробных препаратов между собой и с неантимикробными препаратами. Иногда приходилось разбирать весьма запутанные случаи по побору антибактериальной или антимикотической терапии. Но он был убедителен, что данную тему тоже надо освещать))) и так и появилась эта статья о теоретических предпосылках резистентности и проблемах настоящих и будущих в антимикробной терапии.
Также очень благодарен Антону за неоценимую помощь в корректуре, верстке и размещении статьи без этого читать бы ее было как минимум неудобно))).
Спасибо, конечно, но мои заслуги, на самом деле, сильно преувеличены. Кое-что помог, но статья авторская, поэтому могу претендовать только на роль корректора/верстальщика 🙂
Статья получилась очень классной. Возможно не такой глубокой, как хотелось, по некоторым аспектам, но это повод для написания новых статей по ним. Проблема же имеет место быть, просто о ней пока мало кто задумывается и говорит, как обычно. В основном узкие специалисты, которые участвуют в терапии пациентов, инфицированных такими резистентными микроорганизмами.
Пока жареный петух не клюнет или проблема не приобретет массовый характер, то не заговорят.