Комбинирование различных методов при проведении микробиологических испытаний разных видов контаминантов часто дает намного лучшие результаты, чем их использование по отдельности. Применяемые для этих испытаний методы отбора проб в целом можно разделить на две основные группы. К первой группе относятся методы прямого отбора, с помощью которых определяют уровни остаточной контаминации поверхностей. В частности, их удобно использовать для тех зон, которые наиболее сложны для очистки. Ко второй группе относятся методы непрямого отбора в виде промывочных проб. Непрямые методы предназначены для демонстрации того, что последняя выполненная промывка (обычно водой для инъекций) не содержит контаминантов и, соответственно, как бы сигнализирует о том, что выполненное количество циклов промывания было достаточным и контаминанты больше не извлекаются с поверхности. В тех случаях, когда основной проблемой являются бактериальные эндотоксины, испытание промывочных проб остается единственным практическим способом определения их содержания.
Лица, которые осуществляют отбор проб, должны быть надлежащим образом обучены и одеты в соответствии с требованиями к той зоне, в которой отбираются пробы (например, в чистых помещениях пробоотборщики должны быть одеты в костюмы для чистых помещений, перчатки и маски).
Далее мы рассмотрим подробнее эти основные группы отбора проб для микробиологических испытаний (1):
Прямой отбор проб
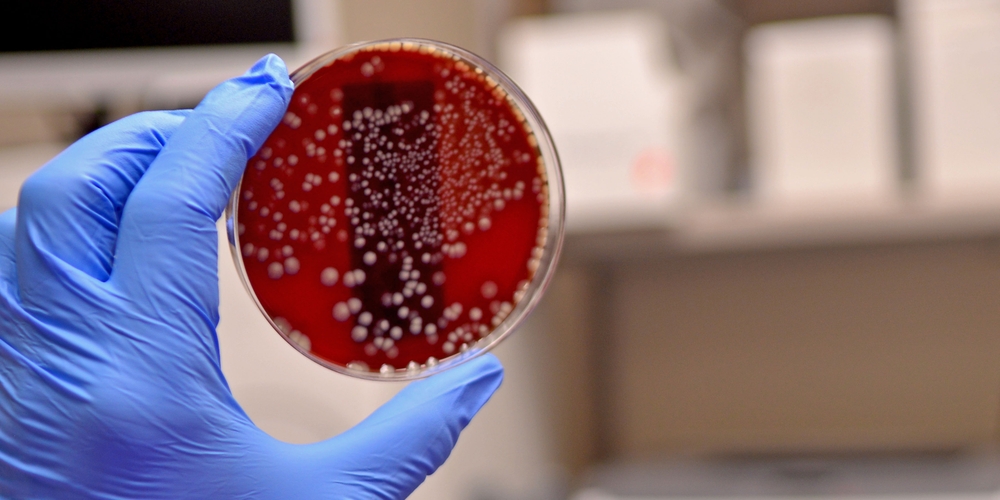
Отбор таких проб осуществляют либо с помощью тампонов, либо с помощью контактных чашек Петри. Из этих двух методов контактные чашки, как правило, позволяют извлечь большее количество микроорганизмов (2). Контактные чашки также могут быть напрямую оценены количественно относительно заданной площади поверхности (на основе площади поверхности агара, которая составляет от 24 до 25 см2). Тампон также можно соотнести с площадью поверхности, но для этого необходимо использовать шаблонную заготовку. Однако возникает вопрос, если квадратную шаблонную заготовку можно плотно приложить к плоской поверхности, то почему бы тогда не использовать вместо него контактную чашку большего размера? Тампоны также более вариабельны в плане смачиваемости кончика тампона, которую тяжело контролировать, а также их тяжелее стандартизировать в отношении количества мазков по сравнению с использованием контактной чашки, которую можно закрепить в аппликаторе и с помощью него контролировать время и давление. Зато тампоны имеют преимущество по сравнению с контактными чашками при взятии проб с оборудования с особой конструкцией поверхности, например, изогнутой или цилиндрической.
Результаты, полученные после отбора проб с помощью контактных чашек и тампонов, позволяют оценить контаминацию участка поверхности. Независимо от выбора метода отбора проб, на основе контактных чашек или тампонов, методика отбора должна быть валидирована до начала проведения исследования, чтобы показать, что она позволяет извлечь с поверхности значительную часть контаминантов. При этом какие-либо стандартные отраслевые нормы для этого отсутствуют, поэтому важно заранее установить уровни содержания микроорганизмов, которые могут постоянно извлекаться с репрезентативного ряда различных поверхностей.
Для того, чтобы извлечь максимальное количество микроорганизмов можно задействовать специальные меры, например, использовать аппликаторы для контактных чашек (с контролем времени и давления) или специальные виды тампонов (например, флок-тампоны с пушистым кончиком позволяют извлечь намного больше, чем тампоны с ровным кончиком). Однако ни один из методов не позволит извлечь полностью все контаминанты. Тем не менее, микробиолог должен знать об ограничениях каждого метода и понимать, какая часть микроорганизмов извлекается. Кроме того, используемые культуральные среды, температура и время инкубации должны быть квалифицированы в отношении содействия оптимальному извлечению. Исследования должны проводиться на месте, поскольку каждый производственный объект является уникальным и для того, чтобы можно было сравнить межлабораторные квалификации, исследования необходимо проводить с использованием эталонных культур.
Учитывая то, что оба метода зависят от методики выполнения, отбор проб должны осуществлять только те операторы, которые прошли обучение по контролю окружающей среды. Кроме того, в тех случаях, когда на поверхности присутствуют остатки какого-либо химического чистящего средства, то для обеспечения достоверности испытания агары, используемые для контактных чашек и для посева с тампона, должны содержать подходящий нейтрализатор дезинфицирующего средства широкого спектра. Комплексная оценка нейтрализатора потребует второго исследования для изучения влияния любого остаточного вещества, используемого при валидации очистки.
При испытании поверхностей с помощью прямого отбора проб также большое значение имеют выбранные места их отбора. Во многих подходах к валидации очистки предполагается, что химические остатки распределяются равномерно по всей поверхности оборудования. И хотя к остаткам химических средств иногда можно применить понятие равномерного распределения, его вряд ли можно будет применить к микроорганизмам. Выбранные места должны включать те, где предположительно присутствует микробная контаминация, а также места, которые потенциально наиболее трудоемкие для очистки. Выбор этих мест должен быть обоснованным, а их количество достаточным для того, чтобы обеспечить адекватную оценку объекта. При определении критериев оценки каждое отдельное место должно соответствовать заданной норме без применения усреднения результатов. Это то, что обычно проверяется инспекторами регулирующих органов.
Промывочные пробы
В отличие от прямого отбора проб, промывочные пробы являются непрямым методом определения чистоты. Промывочные пробы позволяют оценить количество промываний, необходимых для достижения того, чтобы последняя промывочная вода по качеству была такая же, как и та, которую взяли для промывания. Соответственно, если используется вода для инъекций, то норма микробиологической чистоты для взятой для промывания воды составляет 10 КОЕ/100 мл, поэтому для последней промывочной воды должен быть получен аналогичный низкий уровень микробной контаминации. При оценке промывочной воды также полезно одновременно оценивать и воду, взятую для промывания, чтобы оценить разницу в их микробиологической чистоте. Наряду с оценкой качества последней промывочной воды, использование метода промывочных проб позволяет отобрать их с большей площади поверхности по сравнению с методами прямого отбора проб. Этот метод также можно использовать для закрытых систем или частей оборудования, которые невозможно регулярно разбирать для отбора проб и оценки. При этом подразумевается, что промывочная вода достигает и контактирует с этими деталями оборудования (3). Однако, для проверки микробиологической чистоты очищенного оборудования недостаточно использовать лишь метод промывочных проб. Это объясняется тем, что, как указывалось ранее, микроорганизмы могут оставаться прикрепленными к поверхностям и если к таким поверхностям доступ затруднен, то они будут в недостаточной мере обрабатываться химическими средствами или промывочной водой.
Промывочные пробы, как правило, испытывают на микробиологическую чистоту с помощью метода мембранной фильтрации с использованием для испытания не менее 100 мл воды, пропущенной через фильтр с размером пор 0,45 мкм. Этого объема достаточно с точки зрения удовлетворения фармакопейных требований, при условии, что проба является репрезентативной. Можно выдвинуть утверждение, что следует отбирать пробу большего объема, поскольку любые присутствующие микроорганизмы вряд ли будут распределены равномерно. Контраргументом к этому утверждению является то, что если время последнего промывания было должным образом выдержано, то вряд ли можно получить большее извлечение микроорганизмов, соответственно, проба объемом 100 мл является в достаточной мере репрезентативной.
Выбранный для культивирования агар должен быть пригоден для использования с водой (например, для воды для инъекций может подойти агар R2A) (4). Также при испытании проб на микробиологическую чистоту следует сообщать о любых проблемах в сопутствующих химических испытаниях. Например, если обнаружен высокий уровень общего органического углерода, то это может означать, что промывка содержит остатки химического средства, соответственно, это может нивелировать результаты испытания на микробиологическую чистоту. Равно как и может потребовать проведения испытания на эндотоксины.
Испытание на эндотоксины всегда требуется для оборудования, которое подвергается стерилизации и используется в производстве стерильных продуктов. В данном случае оценка на эндотоксины важна еще и по той причине, что присутствие высоких уровней эндотоксинов может подтвердить неэффективность более поздней обработки очищаемого оборудования, то есть стерилизации, поскольку они устойчивы к стандартным температурным режимам стерилизации. Для нестерильного технологического процесса, потребность в испытании промывочной воды на бактериальные эндотоксины должна определяться путем оценки рисков, а наиболее распространенным методом испытания на эндотоксины в воде является ЛАЛ-тест с использованием лизата амебоцитов мечехвоста (5).
Микробиологическая характеристика
Как при использовании контактных методов с прямым отбором проб, так и при испытании последней промывочной воды важно определить естественную микробиологическую контаминацию, а также количество извлеченных микроорганизмов. Извлеченные виды микроорганизмов дают нам информацию о проблемах процесса очистки, а также могут помочь оценить, создают ли выжившие микроорганизмы какие-либо проблемы для последующих процессов дезинфекции или стерилизации, которым будет подвергаться очищенное оборудование. Идентификации микроорганизмов до уровня рода должна быть достаточно для определения потенциальных мест их происхождения.
Рутинный внутрипроизводственный контроль
В ходе оценки очистки также можно учесть последствия использования оборудования в последующем технологическом процессе, то есть после завершения всех методов очистки (и любой последующей дезинфекции или стерилизации). Подобные испытания также основываются на прямых испытаниях микробиологической чистоты продукта с использованием метода определения общего числа аэробных микроорганизмов (TAMC) (например, с помощью чашечного метода или мембранной фильтрации). Следует отметить, что такие испытания являются косвенной мерой оценки и должны использоваться только для подтверждения действительности валидации очистки, но не вместо нее.
Контроль окружающей среды
Для гарантии того, что оборудование хранится в подходящих условиях окружающей среды важно учесть тип этих условий (например, очищенное оборудование должно быть полностью изолировано от неочищенного, а также не должно храниться в зоне с повышенной влажностью, например, на моечной площадке). Сделать это необходимо либо до его использования в технологическом процессе, либо после него. Информацию о пригодности зон можно взять из данных мониторинга окружающей среды, полученных в ходе мониторинга зон хранения оборудования. Эта информация будет являться лишь косвенной мерой, хотя она будет свидетельствовать об общей пригодности зоны с точки зрения контролируемой окружающей среды или средств обеспечения контроля чистых помещений. В дополнение к оценкам окружающей среды важной частью работ по валидации очистки является определение времени хранения оборудования в чистом состоянии. Из всех вышеописанных методов прямой отбор проб является, пожалуй, наиболее важным, при условии выбора правильных мест отбора. Это связано с тем, что результаты анализа последней промывочной воды могут показать, что количество промываний (и предшествующей химической обработки) было достаточным, однако контаминант может остаться прикрепленным к поверхности и не будет обнаружен в промывочной воде.
Установка микробиологических норм
Регулирующие органы не указывают напрямую какие-либо подходящие нормы для микробиологических испытаний. Это объясняется тем, что приемлемые уровни могут быть определены только путем оценки рисков, а это означает, что потребности нестерильного технологического процесса (в котором допускается использование просто очищенного и продезинфицированного оборудования) будут отличаться от таковых для стерильного процесса (в котором оборудование подлежит стерилизации).
Для стерильного процесса допустимое число выживших микроорганизмов будет зависеть от того, насколько проблемными они являются для используемого метода дезинфекции или стерилизации. Этот фактор зависит от таких показателей как наблюдаемое абсолютное число и виды микроорганизмов (например, спорообразующие бактерии могут представлять большую проблему, чем другие микроорганизмы). Для проб последней промывочной воды часто в качестве общего показателя применяют нормы, установленные для воды для инъекций. Несмотря на то, что они не указаны в Фармакопее США (прим. перев. – не совсем ясно, что хотел сказать этим автор. В статье на ВДИ нормы явно не указываются, но в ней стоит ссылка на общую статью <1231>, в которой норма для ВДИ такая же как в ЕФ), в Европейской Фармакопее нормы являются весьма полезным показателем и составляют:
- для испытания на микробиологическую чистоту: не более 10 КОЕ/100 мл;
- для испытания на бактериальные эндотоксины: не более 0,25 ЕЭ/мл.
При прямом отборе проб с поверхности может подойти значение, эквивалентное таковому в испытании на микробиологическую чистоту, то есть не более 10 КОЕ на 1 см2 контактной чашки или на тампон.
Для нестерильного оборудования широко используется формула, разработанная Дохерти (Docherty) в 1999 году (6). Она основывается на допустимых уровнях микроорганизмов в готовом продукте и, соответственно, работает в обратном направлении для определения допустимого количества микроорганизмов на поверхности единицы оборудования (в виде колониеобразующих единиц на квадратный сантиметр). Метод Дохерти постепенно был откорректирован до «универсального» значения 25, например, 25 КОЕ на см2. Ле Блан (Le Blanc), используя аналогичный подход, описал формулу установления нормы для испытания на микробиологическую чистоту при прямом отборе проб (7):
- норму микробиологической чистоты для следующего продукта умножают на минимальный объем серии = значение A
- значение A делят на площадь поверхности, контактирующей с продуктом.
Пример для формулы Ле Блана:
Норма для следующего продукта: 70 КОЕ/г
Минимальный объем серии: 200 000 г
Площадь поверхности, контактирующая с продуктом: 260000 см2
Где:
70 × 200 000 = 14 000 000
Тогда:
14 000 000 ÷ 260 000 = 54 КОЕ/см2
Этот подход зависит от надлежащего проведения испытания продукта на микробиологическую чистоту и от установки подходящих норм (8).
На сегодняшний день эти подходы распространены в меньшей степени и норма чаще всего основывается на анализе ретроспективных данных (9), то есть на анализе того, что обычно извлекается с поверхностей в ряде исследований валидации очистки (с учетом качества продукции и типичных уровней микробиологической чистоты, определенных для готовой продукции). Анализ ретроспективных данных, как правило, приводит к снижению установленных норм и такой подход, исходя из опыта автора, обычно предпочитается инспекторами регулирующих органов.
Напишите в комментариях интересны ли вам подобные статьи по валидации очистки?
Список литературы
- FDA, Guide to Inspections Validation of Cleaning Processes. (Silver Spring, MD, 1993).
- Sandle, T. (20212). Environmental Monitoring: a practical approach In Moldenhauer, J. Environmental Monitoring: a comprehensive handbook, Volume 6, PDA/DHI: River Grove, USA, pp29-54
- Harder, S. W. (1984) The Validation of Cleaning Procedures, Pharm. Technol. 8 (5), 29-34.
- Sandle, T. (2014) Assessment of the suitability of R3A agar for the subculture of microorganisms isolated from pharmaceutical water systems, European Journal of Parenteral and Pharmaceutical Sciences, 19 (3): 85-94).
- Upton, A. and Sandle, T. (2012). Best Practices for the Bacterial Endotoxin Test: A Guide to the LAL Assay, Pharmaceutical Microbiology Interest Group: Stanstead Abbotts, UK
- Docherty, S. (1999) Establishing microbial cleaning limits for non-sterile manufacturing equipment, Pharmaceutical Engineering, 19 (3): 36-40.
- LeBlanc, D. (2002) Equipment Cleaning Validation: Microbial Control Issues, Journal of Validation Technology, 8 (4): 40-46.
- LeBlanc, D. A. (1998) Establishing Scientifically Justified Acceptance Criteria of Finished Drug Products. Pharmaceutical Technology. 19 (5): 136-148
- Walsh, A. (2011) Microbial aspects in cleaning validation. In Saghee, M. R, Sandel, T. and Tidswell, E. C. (Eds.) Microbiology and Sterility Assurance in Pharmaceutical Industry, Business Horizons, New Dehli, pp.1-14.
Автор: Tim Sandle
По материалам IVT Network







Здравствуйте, коллеги!
Нужна практическая рекомендация по изучению dirty equipment-hold time касательно микробиологической оценки.
Есть стерильное производство инфузионных растворов больших объемов. Системы очистки – CIP/SIP.
Подняли вопрос что не изучено сколько можно держать “грязное” оборудование перед очисткой. Если со стороны химии веществ это действительно можно и нужно сделать путем проведения косвенных испытаний, то как бить с микробиологией? Остановить продуктовую линию розлива на несколько часов нет возможности. Границы КОЕ также неведомо как ставить. У меня даже возник вопрос зачем нужно устанавливать микробиологию в ходе этих испытаний и правильности такого изучения.
Сколько может сохранятся оборудование в чистом состоянии мы установили. А вот с “грязным”… В действительности, время хранения оборудования после использования до очистки у нас минимальное – процесс завершился, очистка началась.
Помогите вернутся на путь истины)
Владимир, а вот эту статью не смотрели?
Да, конечно. Там есть пара слов о микробиологии, но лишь для чистого оборудование. Для грязного очень мало и немного не то.
Доброго дня Владимир и Антон. Вопрос интересный но требует ли он отдельного изучения? Может раскроете в чем вам видятся подводные камни. Ведь при валидации CIP/SIP учитываются все факторы которые предвиделись еще на стадии проектирования и составлении ТЗ. Наверно уже не только вами изучены ростовые свойства тех препаратов которые вы льете. или в процессе уже налаженного производства возникла необходимость управлять процессом роста “микробиологии” по сути у вас добавится еще один процесс 🙂 со всеми вытекающими… извините за юмор.
Юрий, в данной статье изначально планировалось затронуть тему микробиологических норм при валидации и рутинной очистке. По ходу подготовки я решил несколько расширить её.
Установка/задание этих норм часто возникающий вопрос, поэтому данную тему можно развивать подробнее.
Спасибо за ответ. Я имел ввиду вопрос Володимира про возможность отвалидировать в “грязном” состоянии. На сколько этот процесс повторяем чтобы попадать под понятие валидация? Такой вопрос в тему ваших публикаций в том числе и “10ppm”. Необходимо ли включать питательную среду применяемую при MFT в анализ рисков очистки оборудования при асептическом производстве. На сколько я понял в перечень для определения “наихудшего случая” должно включатся все с чем контактирует очищаемое оборудование или только продукт? В том числе и применяемые при очистке детергент? Допустим при окончании MFT и переходе на производство воды для инъекций наличие в ВДИ остаточное количество питательной среды повышает риск выпуска некачественного продукта. Просветите пожалуйста. Еще хотел бы уточнить ваше виденье точки отбора промывной воды в системе CIP/SIP реакторов.
Юрий, кажется, я уже писал в каком-то комментарии, что я интересуюсь этими вопросами, но не специалист в них. Без тени претензии к вам, просто не помню, где я это указывал. На уровне теории, поскольку не имеют в этом практического опыта. Кроме того у меня задача поднять вопрос на общее обсуждение, вынести его на поверхность, чтобы подключить к обсуждению всех заинтересованных.
Вы озвучили много интересных практически значимых вопросов. Возможно, лучше вынести их на форум в отдельную тему и там развить дискуссию с другими профильными специалистами. Можете это сделать самостоятельно или, если хотите, могу создать такую тему от вашего имени. На форуме тема лучше заметна и там много функциональных фишек для обсуждения.