Идентификация микроорганизмов играет немаловажную роль в фармацевтических производственных процессах. Определить её можно как «изучение характеристик микроорганизмов с помощью ограниченного спектра испытаний, выбранных заранее и подходящих для изучаемой проблемы» (1). Для идентификации существует целый ряд доступных методов, начиная с дифференциального окрашивания клеточной стенки, впервые использованного Кристианом Грамом (2) и заканчивая современными передовыми методами молекулярной биологии (3). В целом же современные системы идентификации микроорганизмов можно разделить на фенотипические и генотипические.
Матрично-активированная лазерная десорбция/ионизация с времяпролётной масс-спектрометрией (MALDI-TOF MS) является одной из самых последних систем идентификации микроорганизмов, доступных для лабораторий. Несмотря на то, что система является «фенотипической», она, в некотором смысле, устраняет пробел в достоверности результатов испытаний, полученных с помощью биохимических систем фенотипирования и идентификационых систем генотипирования. Система также очень быстра, что делает её хорошим примером «микробиологического экспресс-метода» (4).
Основа метода MALDI-TOF берет свое начало из аналитической химии, а впервые этот метод был предложен Хилленкампом и Карасом в 1988 году для анализа белков (5). Масс-спектрометрия представляет собой метод химического анализа, который используют для измерения массы неизвестных молекул путем ионизации, разделения и обнаружения ионов в соответствии с их отношением массы к заряду (разделяя их на положительные и отрицательные ионы). А данные регистрируют в виде масс-спектров.
«Времяпролетная» составляющая основана на принципе, что время зависит от массы частицы и оно может быть измерено в условиях глубокого вакуума. Поскольку, чем больше масса, тем ниже скорость частицы и тем больше времени требуется до того момента, когда ион столкнется с детектором, что в свою очередь приводит к тому, что разные микроорганизмы формируют различные паттерны или «спектры». Результирующие спектры белка можно сравнить по базе данных и найти соответствие. При этом, время, затраченное на анализ, часто составляет менее двух минут.
В этой статье рассматривается технология MALDI-TOF, а также описываются преимущества и недостатки системы.
Методы идентификации микроорганизмов
Цель идентификации микроорганизмов состоит в том, чтобы дифференцировать одного микробного изолята от другого, а затем определить семейство и вид этого изолят (что является наилучшим результатом, которого можно достичь на уровне фенотипической идентификации) или даже конкретный штамм (посредством генотипической идентификации).
Идентификация микроорганизмов представляет собой определение того, следует ли организм отнести к группе организмов, которые, как известно, попадают под какую-либо систему классификации. Используемые для этого методы идентификации можно разделить на две группы: фенотипические и генотипические. Различие между генотипом и фенотипом описано в классической генетике. «Генотип» — это полная наследственная информация организма, даже если она не проявляется. «Фенотип» — это фактические наблюдаемые свойства организма, такие как морфология, развитие или поведение (6).
Во многих лабораториях в основном распространены фенотипические методы благодаря их относительно низкой стоимости. Однако следует признать, что проявление фенотипических признаков микроорганизма, таких как размер и форма клетки, споруляция, клеточный состав, антигенность, биохимическая активность, чувствительность к антимикробным средствам и так далее, часто зависит от используемых питательных сред и условий культивирования. Фенотипические реакции обычно включают реакции на различные химические вещества или различные биохимические маркеры. Они основываются на более субъективных определениях. Использование биохимических реакций и способов ассимиляции углерода имеет некоторые недостатки в плане достижения стабильной (повторяемой и воспроизводимой) идентификации. Поэтому с целью улучшения классических методов биохимической идентификации в последние годы были сделаны и усовершенствованы некоторые новые разработки. В совокупности эти методы рассматривают как современные методы биохимической идентификации (7).
Примером биохимического профилирования является система идентификации «API» или альтернативная система «BBL-Crystal» (микротрубки, содержащие обезвоженные субстраты). Многие лаборатории в настоящее время используют полуавтоматические системы фенотипической идентификации, такие как «VITEK» или «OmniLog» (миниатюрная система, использующая формат микротитровальных планшетов). Такие фенотипические методы, как правило, работают по принципу исключения. Если испытание A положительное, а B нет, то одну группу возможных микроорганизмов включают, а другую исключают. Исходя из этого выполняют испытания C и D, и так далее. Результаты испытания сравнивают с базами данных, которые работают на основе дихотомического ключа (8).
Генотипические методы не зависят от ростовой среды для выделения микроорганизма или его ростовых характеристик. Эти методы значительно расширили базы данных различных типов микроорганизмов. До появления генотипических методов микробиологи предполагали, что некоторые таксоны существовали, но не культивировались (так называемые «жизнеспособные, но некультивируемые» штаммы). Генотипические методы открыли целый новый ряд видов и подвидов, а также привели к переклассификации видов и родственных видов (таким образом, таксоны, которые при использовании фенотипических методов часто из-за сходства группировали, на самом деле оказались полифилетическими группами, то есть они содержат организмы с различной эволюционной историей, которые являются однородно отличающимися организмами, но были объединены в одну группу). В генотипических методах используют один из двух вариантов: гибридизацию или секвенирование (чаще всего гена, кодирующего 16S рРНК). В случае гибридизации используют метод ДНК-ДНК гомологии (или насколько хорошо две цепи ДНК из разных бактерий связываются [гибридизуются] вместе) (9).
Примером этой технологии является «Riboprinter» (производства «Dupont Qualicon»), автоматическое устройство для Саузерн-блоттинга, в котором используется меченый зонд одноцепочечной ДНК из 16sРНК-кодона. В «Riboprinter» используется фермент рестрикции, поэтому штаммы могут быть идентифицированы и/или охарактеризованы путем анализа схемы полос рибосомальной ДНК.
Другим быстрым методом является система полимеразной цепной реакции (ПЦР), в которой используется форма «бактериальных штрих-кодов», когда амплифицированную генетическую последовательность разделяют с помощью гель-электрофореза и визуализируют с получением «штрих-кода», специфического для конкретного штамма. ПЦР представляет собой метод, в котором с помощью фермента ДНК-полимеразы создают огромное количество копий практически любого фрагмента ДНК или гена. Это позволяет амплифицировать короткий участок ДНК (обычно менее 3000 «пар оснований») примерно в миллион раз. С помощью этого сравнительного теста различия в последовательностях оснований ДНК между разными организмами могут быть определены количественно, таким образом можно построить филогенетическое дерево, чтобы проиллюстрировать вероятную эволюционную связанность между организмами. Примером такой системы является «MicroSeq», производимой компанией «Applied Biosystems» (10).
MALDI-TOF
В основе MALDI-TOF лежит масс-спектрометрия. Масс-спектрометр состоит из трех основных компонентов: источника ионов для ионизации и переноса ионов молекул образца в газовую фазу, масс-спектрометра — устройства, разделяющее молекулы в зависимости от их массы и детектора для мониторинга всех разделенных ионов. Матрично-активированная лазерная десорбция/ионизация с времяпролётной масс-спектрометрией (MALDI-TOF MS) относится к методу мягкой ионизации, используемой в масс-спектрометрии. MALDI считается «методом мягкой ионизации» из-за того, что в нем для ионизации молекул используют короткоимпульсный азотный лазер вместо лазера, работающего в непрерывном режиме. Эта «мягкая» ионизация подразумевает, что образовавшиеся ионы обладают низкой внутренней энергией, что позволяет изучать ионизированные молекулы с незначительной фрагментацией или совсем без нее.
Как единая система, этот метод позволяет анализировать биомолекулы (такие как ДНК, белки, пептиды и сахара) и крупные органические молекулы (такие как полимеры, дендримеры и другие макромолекулы). Эти молекулы, как правило, хрупкие и фрагментируются при ионизации более традиционными методами ионизации. После ионизации, вызванной лазерным лучом, система выполняет сканирование на наличие микробных белков, которые в основном попадают в диапазон от 4000 до 20000 Дальтон (от 60 до 70 % от сухой массы клетки бактерии) (11). Оптимальная воспроизводимость в идентификации микроорганизмов с помощью MALDI-TOF MS основывается на оценке рибосомальных белков, которые обычно присутствуют в клетке в большом количестве.
На основании этих принципов система является быстрым и высоконадежным аналитическим инструментом для определения характеристик разнообразных коллекций микроорганизмов, обнаруживаемых на фармацевтических и медицинских объектах (12).
Через некоторое время метод был коммерциализирован для анализа белкового состава микробной клетки. При этом сравнительные исследования показали, что MALDI-TOF MS является сравнительно эффективным методом идентификации, поскольку это утверждение основывается на его воспроизводимости, скорости и чувствительности анализа (13). Одним из важных преимуществ MALDI-TOF MS по сравнению с другими методами идентификации является время получения результата. При использовании MALDI-TOF результаты, как правило, получают в течение нескольких минут, что обеспечивается относительно быстрым проведением испытания и подготовкой пробы, которая готовится также достаточно быстро и просто.
На рынке производителей MALDI-TOF MS решений существует два основных поставщика:
- компания «bioMérieux» — прибор «Vitek MS»;
- компания «Bruker Daltonics» — прибор «MALDI Biotype».
Метод
На основе этого метода существует два подхода в зависимости от тест-микроорганизма. Обычно истинные колонии выращивают в чашке на подходящей агаровой среде. Как и в большинстве других методов идентификации, колонии должны быть выращены в течение ночи и быть не старее 24 часов перед использованием. Однако в отличие от большинства других методов рекомендуется, чтобы до момента испытания чашки не хранились при температуре 2—8 °C, поскольку холодильное хранение может повлиять на качество спектров. В качестве альтернативы в клинических условиях наряду со специальным набором для экстракции могут быть использованы клинические образцы, например, материал гемокультуры.
Процесс использования MALDI-TOF MS был обобщен Пателем (Patel) и его можно разбить на пять этапов (14, 15):
- Целевую чашку помещают в камеру ионизации масс-спектрометра. Анализируемые пятна обстреливаются ультрафиолетовым азотным лазером, за счет чего молекулы микроорганизмов и матрицы десорбируются с целевой чашки. Лазер, работающий при длине волны 337 нм, генерируется оксидом азота (16). Большая часть энергии поглощается матрицей, переводя ее в ионизированное состояние.
- В результате случайных столкновений в газовой фазе заряд передается от матрицы к микробным молекулам
- Облако ионизированных молекул подается через положительно заряженное электростатическое поле (20 кВ) во время-пролетный масс-спектрометр, представляющий собой трубку под вакуумом.
- Ионы движутся к детектору ионов, причем маленькие аналиты движутся быстрее всего, за которыми следуют постепенно увеличивающиеся аналиты. Импульсный лазер делает отдельные «выстрелы», а не работает в непрерывном режиме.
- Когда ионы выходят из масс-спектрометра они сталкиваются с детектором ионов, генерируя масс-спектр, отражающий количество ионов, попадающих в детектор с течением времени. Хотя разделение осуществляется по отношению массы к заряду, поскольку заряд как правило является одним для описанного применения, разделение обычно более эффективно по молекулярной массе. Это означает, что меньшие ионы достигают детектора TOF раньше, чем более крупные ионы.
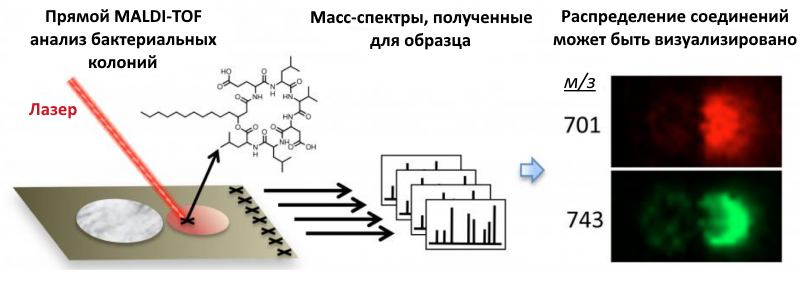
Рисунок 1: упрощенная схема метода MALDI-TOF MS (источник: Matt F. Traxler)
При использовании метода рекомендуется использовать положительный и отрицательный контроль. Контроли могут быть использованы либо для ежедневной калибровки, либо включены в каждое испытание. Положительный контроль — это микроорганизмы, имеющие отношение к лаборатории (обнаруживаемые в ней). Отрицательный контроль — это холостая проба, которая показывает, что целевая чашка чистая.
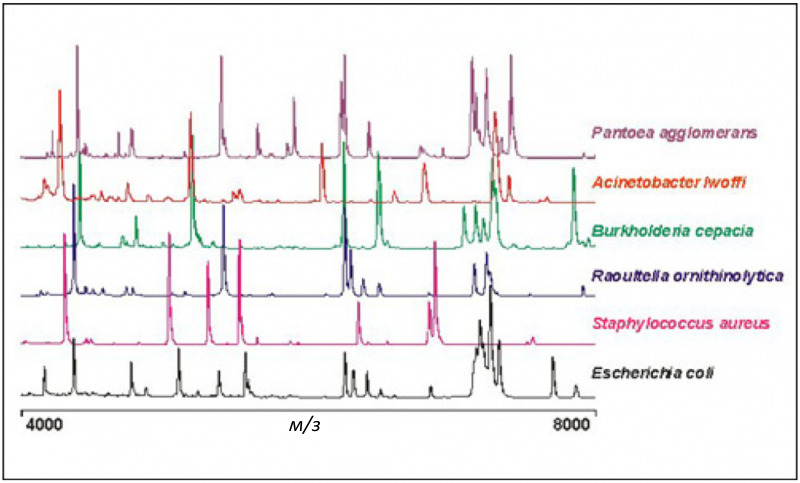
Рисунок 2: пример спектров, относящихся к различным типам бактерий (источник: Anagnostec GmbH)
Сильные и слабые стороны MALDI-TOF
Как и любая из имеющихся в продаже систем идентификации микроорганизмов MALDI-TOF MS имеет свои преимущества и недостатки. Рассмотрим их далее.
Сильные стороны
Разные пользователи систем MALDI-TOF, прежде всего из клинических учреждений, отмечают следующие преимущества системы: (17, 18, 19):
- Система позволяет идентифицировать широкий спектр бактерий, включая грамположительные кокки и палочки, а также ферментирующие и неферментирующие грамотрицательные палочки.
- Система хорошо подходит для определения дрожжей. Система имеет значительные ограничения в отношении идентификации грибов, однако такие как Aspergillus, Fusarium и Penicillium можно точно идентифицировать до видового уровня.
- Система хорошо подходит для анаэробных бактерий.
- В большинстве случаев для испытания достаточно одиночной колонии (большие количества микробной культуры необходимы для дрожжей или мукоидных колоний).
- Система позволяет успешно идентифицировать бактерии, которые считаются сложными для культивирования. Одним из таких примеров являются микобактерии.
- Система также может с некоторым успехом применяться для идентификации вирусов (20).
- Она имеет низкий риск с точки зрения лабораторной безопасности. Это связано с тем, что перед использованием образцы инактивируют путем экстракции.
- Для испытания требуется минимальное количество расходных материалов. Покупка самой системы сопряжена с относительно высокими затратами, однако эксплуатационные расходы низкие.
- При необходимости система может быть расширена.
- Результаты, как правило, воспроизводимы.
Слабые стороны
Основные слабые стороны этой системы были выявлены Агентством здравоохранения Великобритании, органом общественного здравоохранения Англии и другими организациями (21). Они включают:
- В результате присутствия эндоспор бактерий, таких как Bacillus spp., могут возникать спектральные помехи. Для их предотвращения могут быть использованы молодые культуры (22).
- Иногда масс-спектрометрические спектры не позволяют легко дифференцировать сходные или близкородственные организмы (такие как виды Escherichia coli и Shigella, или различные дрожжи).
- При использовании в клинических лабораториях нет возможности дифференцировать между собой штаммы одного и того же вида, устойчивые и чувствительные к антибиотикам (23).
- Некоторые микроорганизмы не всегда могут быть идентифицированы. Наиболее низкие результаты система продемонстрировала в отношении микобактерий, видов Burkholderia, видов Acinetobacter, коринебактерий и β-гемолитических стрептококков. Это связано с их генетическим родством (24).
- Как и для любой системы идентификации, надежность идентификации основана на том, насколько обширна база данных (25). Базы данных для MALDI-TOF имеют клиническую направленность и должны быть дополнены для использования в промышленной и фармацевтической микробиологии. В основном это упирается в качество эталонных спектров (26). Однако при обучении по шаблонам, методы машинного обучения должны быть в состоянии использовать информацию, встроенную в данные, так, чтобы предыдущие «неизвестные» могли быть распознаны повторно.
- Микроорганизмы, образующие капсулы, более устойчивы к лизису клеток. Это может привести к более низкой экстракции, а следовательно к менее качественным спектрам и, таким образом, к ошибочной или нулевой идентификации. Пауэлл и его коллеги сообщали о недостатках MALDI-TOF MS при дифференцировании Streptococcus pneumoniae и Streptococcus mitisas, а также Haemophilus influenzae и Klebsiella pneumoniae (27). Вследствие этих возможных ошибок некоторые пользователи рекомендовали проводить испытания в двух повторах и усреднять спектральный результат.
- В зависимости от типа используемых питательных сред, последние могут создавать помехи. Среда, выбранная для верификации методики, должна использоваться в качестве стандарта во всех последующих идентификациях. Эта проблема с питательными средами отчетливо показывает в чем кроется основная причина недостатков MALDI-TOF MS в сравнении с другими фенотипическими методами.
Верификация метода
Очень важно, чтобы при внедрении для практического использования в лаборатории любой метод микробиологической идентификации был верифицирован (квалифицирован). Для начала работы с автоматизированным прибором необходимо выполнить следующие этапы:
- квалификация монтажа: это документальное подтверждение того, что оборудование и связанные с ним системы, такие как программное обеспечение, аппаратное обеспечение и вспомогательные средства, надлежащим образом установлены, а соответствующая документация проверена. Документация может включать руководства по эксплуатации, сертификаты, методики и протоколы калибровки.
- квалификация функционирования: в ходе неё проверяют и подтверждают, что система или подсистема работает как и ожидается в рамках всех предполагаемых рабочих диапазонов, а также документируют необходимую информацию.
- квалификация эксплуатации: в ходе неё подтверждают, что система работает стабильно, как и предусмотрено при нормальной эксплуатации, а также соответствует нормативным требованиям и ожиданиям или требованиям пользователей. Эффективная эксплуатация автоматизированной системы микробиологической идентификации очень сложна и времязатратна вследствие множества факторов, таких как выбор изолятов, вариабельность со стороны оператора и воспроизводимость самой системы.
В последующем для демонстрации пригодности самой методики требуется валидация или верификация, в случае неавтоматизированных систем. Проверка обычно включает (28):
- Параллельные испытания с использованием существующей системы и примерно 50 микробных изолятов.
- Испытание от 12 до 15 репрезентативных исходных культур часто выделяемых видов (необходимо убедиться, что они имеют достаточно широкий диапазон для охвата большей части испытательного массива приборов). В идеале следует использовать типовые штаммы.
- Подтверждение того, что от 20 до 50 микробных идентификаций, включая от 15 до 20 различных видов, согласуются с результатами контрольных лабораторных испытаний разделенного образца.
Ключевыми оцениваемыми критериями являются (29):
- Правильность, которую выражают в процентах путем деления количества правильных результатов на количество полученных результатов и умножения на 100.
- Воспроизводимость, которую аналогично выражают в процентах. Для этого количество правильных согласующихся результатов делят на общее количество результатов и умножают на 100.
Резюме
В этой статье описано, как масс-спектрометрия может быть задействована для идентификации и классификации микроорганизмов с использованием маркерных белков (характерных паттернов экспрессии белка, которые сохраняются и используются в качестве специфических биомаркерных белков для перекрестного сравнения).
Как описано в статье, при идентификации бактерий с помощью такого устройства, как прибор матрично-активированой лазерной десорбции/ионизации времяпролетной масс-спектрометрии (MALDI-TOF), отдельную изолированную колонию или простой клеточный экстракт помещают на целевую чашку из нержавеющей стали и покрывают поглощающим ультрафиолет веществом. Целевую чашку помещают в прибор MALDI-TOF. Затем обрабатывают образец с помощью азотного импульсного лазера для ионизации белков. После чего их разделяют на основании их отношения масса/заряд. Полученные спектр маркерных белков (которые находятся в диапазоне 2000—20000 Дальтон) сравниваются по базе данных известных спектров.
Этот метод, несмотря на описанные ограничения, является быстрым, эффективным и подходит для лабораторий, которым требуется обрабатывать большой объем образцов и которых устраивают получаемыми результаты на основе фенотипических проявлений.
Литература
Автор: Tim Sandle
Перевод и подготовка: Дмитрий Михайленко
Дополнения: Антон Мымриков
По материалам ivtnetwork.com