Appendix IV of the Guideline on the Investigation on Bioequivalence (CPMP/EWP/QWP/1401/98 Rev.1): Presentation of Biopharmaceutical and Bioanalytical Data in Module 2.7.1
Содержание
1. Введение
Целью модуля 2.7.1 ОТД является обобщение всей релевантной информации в досье к подаваемой заявке на получение регистрационного удостоверения в отношении биофармацевтических исследований и связанных с ними аналитических методов.
Это приложение содержит набор шаблонов таблиц, помогающих заявителям при подготовке модуля 2.7.1 представить соответствующие данные в соответствии с требованиями основного руководства. Также, предполагается, что стандартизированное представление будет способствовать ускорению процесса оценки. Поэтому при подготовке модуля 2.7.1 заявителям рекомендуется использовать эти шаблоны таблиц. Это приложение предназначено для заявок на генерические препараты в соответствии с Директивой 2001/83/ЕС, статья 10 (1). Кроме того, в случае необходимости, также рекомендуется использовать эти шаблоны таблиц для других заявок, таких как внесение изменений, регистрация фиксированных комбинаций, расширенных и гибридных заявок.
2. Инструкции по заполнению и подаче таблиц
Таблицы должны быть заполнены только для базовых исследований, как указано в досье заявки, в соответствии с разделом 4.1 Руководства по биоэквивалентности (CPMP/EWP/QWP/1401/98 Rev. 1). При наличии более чем одного базового исследования биоэквивалентности, для каждого исследования должны быть подготовлены отдельные таблицы. В дополнение, для таблиц должны быть соблюдены следующие инструкции:
- Информация о незарегистрированных в ЕС референтных препаратах не требуется.
- Таблицы в разделе 3 должны быть заполнены отдельно для каждого аналита в исследовании. Если исследуемых препаратов больше одного, то структура таблицы должна быть скорректирована.
- Таблицы в разделе 4 должны быть заполнены только для той методики, которая используется в утвержденных (базовых) исследованиях биоэквивалентности. Если измеряли более одного аналита, тогда таблица 4.1 и потенциально Таблица 4.3 должны быть заполнены для каждого аналита.
В общем случае, заявителям рекомендуется использовать перекрестные ссылки и сноски для добавления дополнительной информации. Поля, которые не используются должна быть заполнены, как «Не используется» вместе с пояснительной сноской, если необходимо.
Дополнительно, каждый раздел шаблона должен иметь перекрестные ссылки на местонахождение сопроводительной документации или исходные данные в досье заявки.
Таблицы не должны быть сканированными копиями и их содержание должны быть доступными для поиска. Настоятельно рекомендуется, чтобы заявители предоставляли Модуль 2.7.1 и в формате Word (.doc) или RTF.
3. Примечание по документации для биовейвера основанного на БСК
Соответствующие данные для биовейвера основанного на БСК должны быть включены в модуль 5.3.1 “Отчеты по сравнительному исследованию БД и Биоэквивалентности (БЭ)”. Резюме данных должно быть представлено в модуле 2.7.1 с обоснованием биовейвера основанного на БСК и перечнем соответствующих ссылок.
1. Запрос на биовейвер для разных дозировок
Таблица 1.1 Качественный и количественный состав испытуемого препарата.
 * Каждый ингредиент, выражается в процентах (масса/масса) от общего ядра или масса покрытия или % масса/объем для растворов.
* Каждый ингредиент, выражается в процентах (масса/масса) от общего ядра или масса покрытия или % масса/объем для растворов.
Инструкции
Включите состав для всех дозировок. При необходимости добавьте дополнительные колонки.
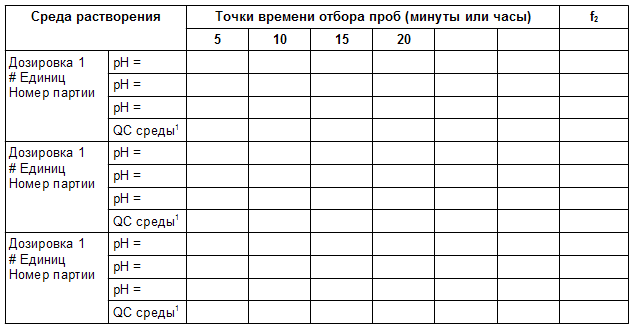
Таблица 1.2 Данные по in vitro растворению для запроса биовейвера.
 1 Только если среда предназначенная для высвобождения препарата отличается от буферов выше.
1 Только если среда предназначенная для высвобождения препарата отличается от буферов выше.
Инструкции
Заполните эту таблицу только в том случае, если биовейвер требуется для дополнительных дозировок, кроме тех, которые прошли испытание в исследовании биоэквивалентности. Следует сообщать только средние значения процента растворения, но обозначать звездочкой (*), если соответствующий RSD превышает 10%, за исключением первой точки, для которой граница RSD составляет 20 %. Расширьте таблицу дополнительными колонками по количеству точек отбора проб. Если дозировок больше 3 добавьте дополнительные строки. f2 значения должны быть рассчитаны по отношению к дозировке, которая использовалась в исследовании биоэквивалентности. Обоснуйте в тексте, если использовался альтернативный метод оценки, а не f2.
2. Информация по исследованию биоэквивалентности
Таблица 2.1 Информация о исследуемом и референтном препаратах.
 1 Перечень для каждого активного вещества для фиксированных комбинаций.
1 Перечень для каждого активного вещества для фиксированных комбинаций.
Инструкции
Если использовалась более чем одна партия исследуемого и референтного препаратов в исследованиях биоэквивалентности, следует заполнить таблицу 2.1 для каждой партии комбинации Исследуемый/Референтный.
Таблица 2.2 Место(а) проведения Исследования <Исследование №>
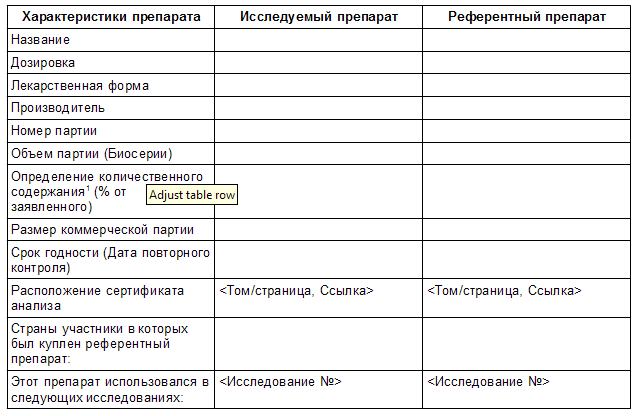
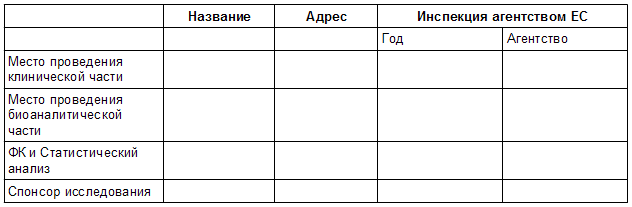 Таблица 2.3 Описание исследования <Исследование №>
Таблица 2.3 Описание исследования <Исследование №>
 Инструкции
Инструкции
Заполните Таблицы 2.2 и 2.3 для каждого исследования.
3. Результаты
Таблица 3.1 Фармакокинетические данные для <аналита> в <Исследовании №>
 1 – AUC(0-72ч) может быть представлена вместо AUC(0-t), в исследованиях с периодом отбора проб 72 ч и возможностью количественного определения концентрации в точке 72 ч. Только для препаратов с немедленным высвобождением.
1 – AUC(0-72ч) может быть представлена вместо AUC(0-t), в исследованиях с периодом отбора проб 72 ч и возможностью количественного определения концентрации в точке 72 ч. Только для препаратов с немедленным высвобождением.
2 – Нет необходимости указывать AUC(0-∞), если вместо AUC(0-t) указывается AUC(0-72ч).
3 – Медиана (Мин, Макс)
4 – Среднее арифметическое (± стандартное отклонение) может быть заменено на Среднее геометрическое (± CV%)
Таблица 3.2. Дополнительные фармакокинетические данные для <аналита> в <Исследовании №>
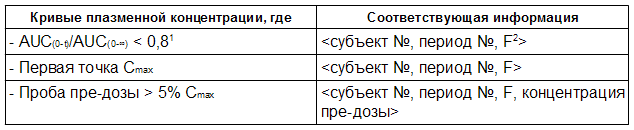 1 – Только если последняя точка отбора проб AUC(0-t) меньше, чем 72 часа
1 – Только если последняя точка отбора проб AUC(0-t) меньше, чем 72 часа
2 – F = T для исследуемого препарата или F = R для референтного препарата.
Таблица 3.3 Оценка биоэквивалентности <аналита> в <Исследовании №>
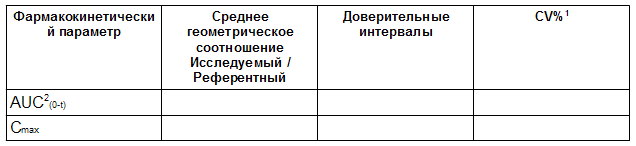 1 – Оценивается по остаточным средним квадратам. Для исследований с повторяющимся дизайном необходимо сообщить внутрисубъектный CV%, используя данные только референтного препарата.
1 – Оценивается по остаточным средним квадратам. Для исследований с повторяющимся дизайном необходимо сообщить внутрисубъектный CV%, используя данные только референтного препарата.
2 – В некоторых случаях AUC(0-72)
Инструкции
Заполните Таблицы 3.1-3.3 для каждого соответствующего аналита.
4. Биоаналитика
Таблица 4.1 Валидация биоаналитического метода
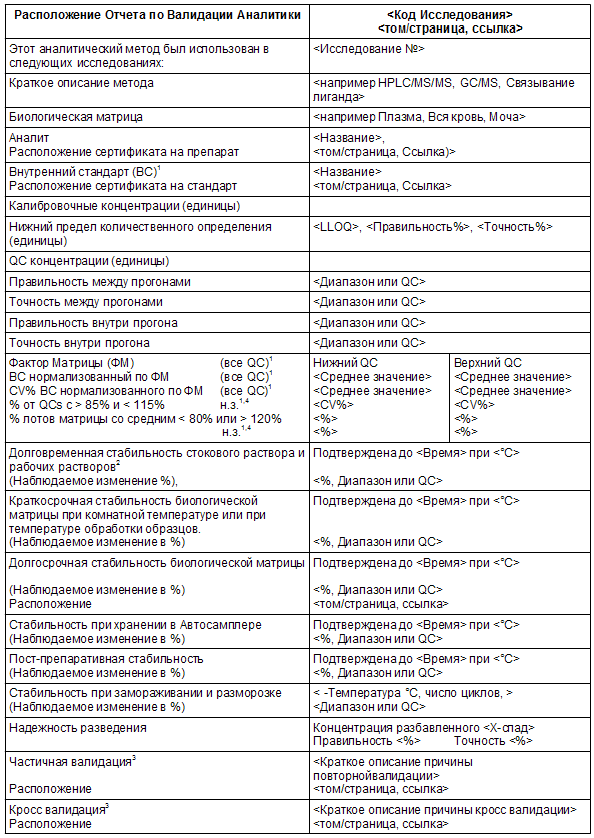 1 – Не могут применяться для данного аналитического метода.
1 – Не могут применяться для данного аналитического метода.
2 – Предоставить результаты краткосрочной стабильности, если нет данных по изучению долговременной стабильности для стокового и рабочего растворов.
3 – Эти строки не являются обязательными. Сообщить о любой валидации которая была завершена после первоначальной валидации.
4 – н.з. = номинальное значение
Указания
Многие записи в таблице 4.1, применимы только для хроматографических методов, но не для метода связывания лиганда. Используйте обозначение NA, если запись не соответствует данному анализу. Заполнять таблицу 4.1 необходимо для каждого соответствующего аналита.
Таблица 4.2 Срок хранения исследуемых образцов
1 – Только для пилотных исследований
Таблица 4.3 Анализ образца <Исследование №>
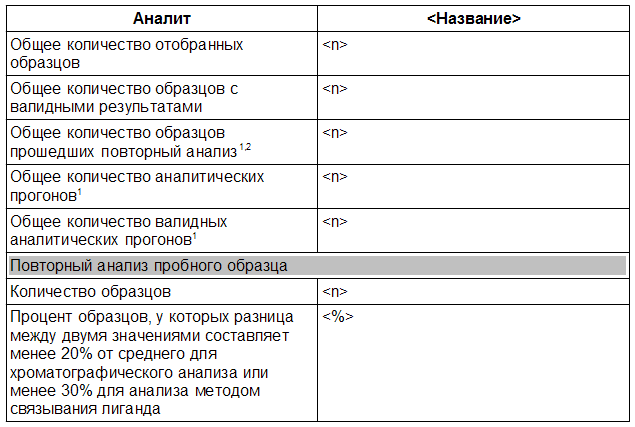 1 – Без пробных образцов.
1 – Без пробных образцов.
2 – Вследствие других причин, но не из-за невалидного прогона.
Инструкции
Заполните таблицу 4.3 для каждого соответствующего аналита.
Таблицы в редактируемом формате прилагаю (для удобства): скачать Appendix 4 BE Tables