Валидация очистки на нестерильном производстве подробно рассмотрена здесь и здесь
Теперь предлагаю поговорить о валидации очистки на инъекционном производстве.
Технология.
Приготовление раствора, Стерилизующая фильтрация, Розлив во флаконы, Лиофилизация,
Укупорка, Фасовка и упаковка.
Рассмотрим несколько ситуаций.
1. Идеальная. На этой линии выпускается один препарат.
2. Реальная. На линии выпускается один препарат и проводится розлив питательной среды.
3. Самая реальная. На линии выпускается несколько препаратов и проводится розлив питательной среды.
4. Совсем совсем реальная Все те же самые ситуации только еще и используется моющее/дез.средство.
Теперь вопросы к сообществу:
1 Что необходимо удалить?
2 Как рассчитать критерии приемлемости того что надо удалить?
3 Допустимое количество остатков питательной среды?
4 Методики определения остаточных количеств и их валидация.
Всем заранее спасибо.
Коллеги, кто что думает по такой проблеме? При обосновании критериев получилось, что МАСО очень маленькая величина. Если перевести в ТОС, то мыться придется в 10 раз лучше, чем до воды для инъекций. Как лучше поступить в такой ситуации?
Уважаемый Leonid111.
Величина МАСО - это всего лишь один из вариантов, который нужно сравнить со значением критерия 10ррм и критерия "визуально чисто". Далее, какой подход Вы выбрали при расчета МАСО? Через дозу или токсичность?
На сколько маленькое значение Вы расчитали?
Учитывая тот факт, что ТОС есть неспецифичный метод для обнаружения остатка в промывной воде, Вам нужно определиться со специфичной методикой обнаружения остатка и провести валидацию этой методики. Например, Вы можете рассматривать наиболее приемлемый вариант в виде спектрофотометрии в УФ-области (или ближней ИК), однако предел обнаружения может оказаться выше чем рассчитанный Вами допустимый предел остатка, следовательно таким методом Вы не сможете обнаружить остаток, хотя он будет присутствовать в незначительных (мизерных) количествах.
ВЭЖХ конечно покруче, но и возиться с валидацией методики хлопотно (если у Вас такой прибор имеется конечно). Хемолюминисцентный метод тоже хорош, но не всегда подходит.
Для предметного обсуждения уточните от чего, чем и как отмываетесь.
@genius писал(а):
Для предметного обсуждения уточните от чего, чем и как отмываетесь.
Отмываемся от новокаина (прокаина гидрохлорида), МАСО считаем по терепевтическим дозам, значение 0,015 г. C учетом площадей оборудования и объема смывной воды получили максимальную допустимую концентрацию 0,00008 г/л. Отмывка идет водой PW и WFI.
В Вашем случае возможно применить уф-спектрофотометрическое определение остатков новокаина по методике в прикрепленном файле. Конечно необходимо провести работу по апробации и валидации данной методики (т.е. я имею в виду попробовать ее в ваших условиях). Если будет воспроизводиться, вперед с песней валидируйте методику и определяйте остаток. @Leonid111 писал(а):
Если перевести в ТОС,
не нужно сюда ТОС, используйте спец. метод. Так будет лучше для всех.
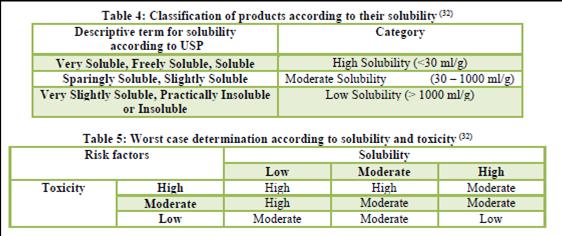
Однако, у меня возникло сомнение в том, что Вы правильно определились с выбором наихудшего случая, учитывая тот факт, что новокаин есть очень легко растворимый АФИ. Мне кажется, Вы анализ рисков не проводили (учитывая факт выбора очень легко растворимого АФИ). Также есть подозрение, что МАСО выбран ошибочно. Без обид, но я уверен, что на Вашем предприятии есть более трудные случаи отмывки.
Если Вы считаете новокаин наихудшим случаем, то Вам можно было бы использовать критерий 10ррм и не морочить голову с терапевтическими дозами. Однако методика должна быть и должна быть валидированной. В противном случае качество Ваших препаратов под большим вопросом.
С уважением,
genius
@genius писал(а):
Без обид, но я уверен, что на Вашем предприятии есть более трудные случаи отмывки.
Мы выбираем самый сильнодействующий и самый трудноотмываемый. Валидацию хотим проводить по этим двум препаратам. Новокаин это как раз самый сильнодействующий, т.е самое маленькое MACO.
@genius писал(а):
Если Вы считаете новокаин наихудшим случаем, то Вам можно было бы использовать критерий 10ррм и не морочить голову с терапевтическими дозами.
Разве можно использовать критерий 10ррм, если по терапевтическим дозам получаются более жесткие рамки??Мы проводим расчет и по дозам и по 10ррм, а потом выбираем худший случай.
@Leonid111 писал(а):
Разве можно использовать критерий 10ррм, если по терапевтическим дозам получаются более жесткие рамки?
А Вы перед этим где-то упоминали об этом?
@Leonid111 писал(а):
Мы выбираем самый сильнодействующий и самый трудноотмываемый.
Так какой Вы выбрали для наихудшего случая? Тот который очень легко моется, но в принципе если не мыть или плохо мыть, то очень сильнодействующий? Или менее сильнодействующий, но мыть водой бесконечно долго? А может Вам нужно две различных процедуры очистки технологического оборудования: обычная - для легкорастворимого но сильнодействующего АФИ, вторая - для трудноотмываемого АФИ?
Что касается дозы и токсичности. Если вы оцениваете АФИ только по дозе, то следовательно вы не полностью оцениваете риск токсичности. Величина ЛД50 для пути введения также должна рассматриваться при выборе наихудшего случая.
Вот для интереса:
можно рассмотреть вариант концентрирования пробы, т.е. ее насыщения. Кроме того если у вас нет пока методики по обнаружению этого остатка, то, соответственно, вы не можете сделать вывод о факторе высвобождения Recovery. Можно еще рассмотреть возможность отбора проб свабом, возможно, ваш критерий на единицу площади будет на порядок выше критерия по промывной воде.
@genius писал(а):
Так какой Вы выбрали для наихудшего случая? Тот который очень легко моется, но в принципе если не мыть или плохо мыть, то очень сильнодействующий? Или менее сильнодействующий, но мыть водой бесконечно долго? А может Вам нужно две различных процедуры очистки технологического оборудования
Вообще предполагалось выбрать один режим мойки, при котором отмоется и самый сильнодействующий, и трудноотмываемый до концентраций, рассчитанных по терапевтическим дозам. Но теперь скорее всего будем разбивать на группы.
У нас еще проблема в том, что в одних и тех же реакторах готовят и капли (глазные, назальные), и инъекционные растворы. Можно ли использовать в этом случае критерии 10ppm и терапевтических доз или нет?
@generationP писал(а):
можно рассмотреть вариант концентрирования пробы, т.е. ее насыщения.
как именно это можно сделать?
@Leonid111 писал(а):
как именно это можно сделать
если АФИ не термолабильный, банально упарьте.
@Leonid111 писал(а):
Можно ли использовать в этом случае критерии 10ppm и терапевтических доз или нет?
можно, а также критерий "визуально чисто".
как упомянул generationP, тест "рекавери" обязательно нужно провести.
обычно при валидации методики определения остатка АФИ этот тест подразумевается.
Зарубежные "валидаторы очистки" предлагают для критерия "визуально чисто" использовать "спайкинг-тест" т.е. умышленное загрязнение заранее известным количеством АФИ пластины из аналогичного материала из которого изготовлено оборудование. Рассматривая загрязненную пластину при различном освещении и под разными углами можно установить предел заметности остатка АФИ на пластине. В дальнейшем можно использовать эту же пластину для "рекавери" теста.
Сравнив значения минимум трех критериев можно выйти на необходимый обоснованный предел остатка АФИ.
Тема валидации очистки на самом деле очень глубока и интересна.
Если знаете кроме английского еще хотя-бы французский, то много можете найти интересного в сети. Я лично скачал пару французских диссертаций по валидации очистки датируемых до 2005 года. Итальянцы и испанцы тоже в этом вопросе тему раскрыли. Агалоко и товарищи позже раскрутили эту тему на уровень ПДА ТР29 (2012). Немцев не мониторил, язык этот для меня очень труден.